Empresa recolhe produtos de CBD injetáveis após carta de aviso da FDA
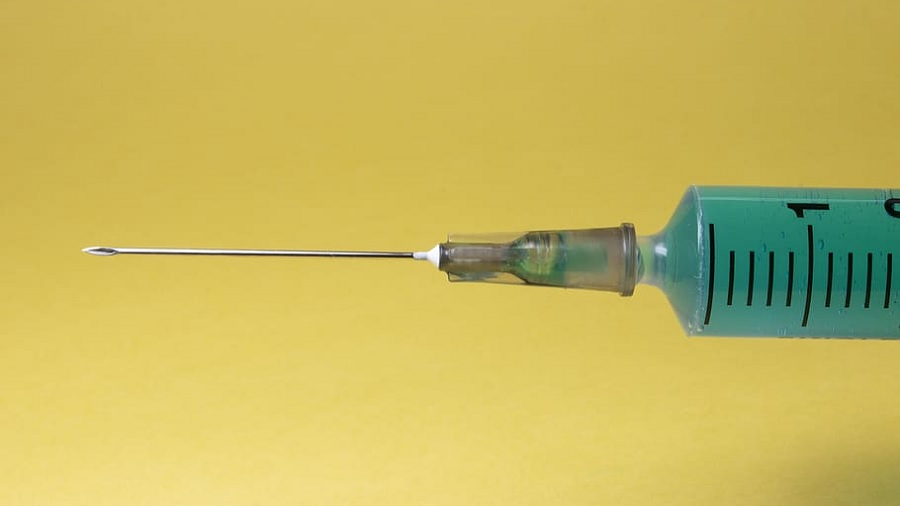
Embora os produtos não tenham instruções de uso, a empresa alega que eles contornam a absorção hepática e entregam o CBD diretamente na corrente sanguínea. Com informações do Marijuana Moment e tradução Smoke Buddies
Uma carta da Food and Drug Administration (FDA) alertando uma empresa sobre a comercialização de produtos injetáveis de CBD levou a um recall voluntário que a agência federal anunciou na quarta-feira.
A Biota Biosciences recebeu a carta no mês passado, com a FDA orientando a empresa a interromper as vendas de sua linha de ampolas de CBD, que ela comercializa como um analgésico que serve como uma alternativa aos opioides e pode ajudar na desintoxicação.
A agência disse que a empresa estava violando os estatutos federais ao se envolver no comércio interestadual de uma nova droga não aprovada e ao não rotular adequadamente os produtos, deixando de incluir instruções de uso.
“As drogas injetáveis podem representar um sério risco de danos aos usuários porque são entregues diretamente na corrente sanguínea e desviam muitas das defesas naturais do corpo contra ingredientes tóxicos, toxinas ou organismos perigosos que podem levar a condições graves e com risco de vida, como septicemia ou sepse”, escreveu a FDA.
Em uma resposta pública publicada na sexta-feira, a empresa disse aos consumidores que “gostaríamos de transmitir que a equipe executiva e de gerenciamento da Biota Biosciences assume total responsabilidade por essas observações e entende a gravidade do risco para os consumidores publicando essas alegações e pretensões de uso não aprovadas em nosso site”.
Os produtos sujeitos ao recall incluem formulações do Complexo de Canabidiol (CBD), Complexo de Curcumina e Canabidiol + Curcumina. “Todos os clientes que receberam este produto terão a opção de manter qualquer produto restante ou receber um reembolso total pela devolução de produtos não utilizados”, afirmou a empresa.
Desde que recebeu a carta de aviso da FDA, a empresa diz que retirou todos os produtos, forneceu à agência uma “causa raiz e plano de ação corretiva” e lançou um recall voluntário das ampolas.
De acordo com a carta de advertência original, os produtos de CBD atendem à definição de droga sujeita à regulamentação da FDA por que “eles se destinam ao uso no diagnóstico, cura, mitigação, tratamento ou prevenção de doenças e/ou afetam a estrutura ou qualquer função do corpo”, continua a carta.
A FDA identificou vários exemplos de alegações médicas feitas pela Biota Biosciences sobre suas ampolas de CBD na publicidade:
“Combatendo a epidemia de opioides… A BIOTA Biosciences produz e distribui alternativas totalmente naturais eficazes, sem efeitos colaterais. Junte-se às crescentes fileiras de profissionais de saúde em dor, oncologia, psiquiatria e naturopatia, utilizando as ampolas estéreis de CBD BIOTA.”
“VISÃO: FUTURO LIVRE DE OPIOIDE… Nosso objetivo é abastecer o mundo com produtos de grau farmacêutico totalmente naturais que contenham canabidiol e outros compostos naturais. Acreditamos firmemente que o óleo de cânhamo de grau farmacêutico reduzirá drasticamente a necessidade de alívio da dor com base em opioides e eliminará a epidemia global de opioides, fornecendo uma alternativa segura e natural.”
“Alívio instantâneo para pacientes sintomáticos de doenças autoimunes inflamatórias.”
FDA adverte 15 empresas por venderem ilegalmente vários produtos contendo CBD
Embora os produtos não tenham instruções de uso, a empresa alega que eles contornam a absorção hepática e entregam o CBD “diretamente em sua corrente sanguínea”.
Além disso, a FDA enfatizou que mesmo que os rótulos contivessem informações de uso eles ainda estariam violando.
“Novas drogas não podem ser introduzidas ou entregues legalmente para introdução no comércio interestadual sem a aprovação prévia da FDA”, afirma a carta. “A FDA aprova uma nova droga com base em dados e informações científicas que demonstram que a droga é segura e eficaz”.
As ampolas injetáveis de CBD “são oferecidas para condições que não são passíveis de autodiagnóstico e tratamento por indivíduos que não são médicos; portanto, instruções de uso adequadas não podem ser escritas para que um leigo possa usar essas drogas com segurança para os fins a que se destinam”.
“As violações citadas nesta carta não pretendem ser uma declaração abrangente de violações que existem em conexão com seus produtos comercializados. Você é responsável por investigar e determinar as causas das violações identificadas acima e por impedir sua recorrência ou a ocorrência de outras violações. De acordo com o seu site, você fabrica muitos outros tipos de produtos que contêm CBD. É sua responsabilidade garantir que sua empresa cumpra todos os requisitos da lei federal, incluindo os regulamentos da FDA.”
A FDA concedeu à Biota Biosciences 15 dias após o recebimento da carta para notificá-los sobre as medidas corretivas adotadas. A falha na solução dos problemas poderia resultar em “ação legal sem aviso prévio, incluindo, sem limitação, apreensão e liminar”.
Em sua declaração pública, a Biota Biosciences disse que até agora “nenhum evento adverso grave ou adverso foi relatado em relação a esses produtos”. A FDA está pedindo aos consumidores que possam ter essas experiências para relatá-las ao programa MedWatch Adverse Event Reporting.
Esta é uma das mais recentes declarações da FDA sobre empresas de CBD que não estão cumprindo seus padrões.
No início desta semana, a agência divulgou um recall voluntário de outro produto CBD de uma empresa diferente, notificando os consumidores sobre níveis potencialmente altos de chumbo em um lote de tinturas.
A FDA disse que atualmente está mirando empresas que fazem alegações especialmente estranhas e não autorizadas sobre o potencial terapêutico de seus produtos de cannabis.
Por exemplo, ela enviou uma carta de aviso a uma empresa de CBD de propriedade de um ex-jogador da NFL depois que os anúncios exibidos sugeriram que seus produtos poderiam tratar e prevenir uma infecção por coronavírus.
A FDA já havia emitido avisos a outras empresas de CBD que fizeram alegações infundadas sobre o potencial terapêutico de seus produtos.
Embora a agência atualmente não aprove o CBD como um item alimentar ou suplemento dietético, está em processo de desenvolvimento de regulamentos que podem permitir essa comercialização.
Leia também:
60% dos consumidores de CBD dos EUA usam o composto para descontrair, diz estudo
#PraCegoVer: em destaque, fotografia que mostra a ponta de uma seringa com agulha, preenchida com uma substância verde, na horizontal e um fundo amarelo. Foto: Pixabay.
- Brasileiro conta como abriu seu coffee shop em Barcelona - 17 de abril de 2024
- O que muda com a aprovação da PEC das Drogas pelo Senado? - 17 de abril de 2024
- Flores de cannabis da marca de Mike Tyson são alvo de recall na Califórnia (EUA) - 16 de abril de 2024
- STF define que abordagem policial motivada pela cor da pele é ilegal - 15 de abril de 2024
- Ver de Perto: Luis Navarro produz série documental sobre maconha - 15 de abril de 2024
- Mercado legal de cannabis emprega mais de 440 mil pessoas nos Estados Unidos - 14 de abril de 2024












